Microcystine
La microcystine est le type de cyanotoxine le plus étudié à ce jour, et contenant plus de soixante-dix variantes. Cette molécule est constituée de sept acides aminés qui se rejoignent aux extrémités pour former une structure cyclique.
Recherche sur Google Images :
Source image : www.eaubretagne.fr Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- et deux nouveaux acides D-aminés. Les microcystines sont appelées selon... l'ADDA et du peptide cyclique rend les deux éléments non toxiques... (source : ffcanoe.asso)
- Les microcystines, peptide cyclique de 7 acides aminés.... Suite à cette liaison l'acide aminé Adda (acide 3-amino-9-méthoxy-2-6... (source : snv.jussieu)
La microcystine est le type de cyanotoxine le plus étudié à ce jour, et contenant plus de soixante-dix variantes[1]. Cette molécule est constituée de sept acides aminés qui se rejoignent aux extrémités pour former une structure cyclique.
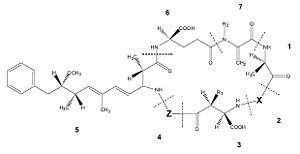
Squelette de la microcystine : 1, D-Alanine ; 2, X (variable) ; 3, D-MeAsp (D-érythro-?-méthyl-D-acide aspartique) ; 4, Z (variable) ; 5, Adda (acide (2S, 3S, 8S, 9S) -3-amino-9-méthoxy-2-6-8-triméthyl-10-phényldéca-4, 6-diènoïque) ; 6, D-glutamate; 7, Mdha (N-méthyldéhydroalanine). R1 et R2 sont H (déméthylmicrocystines) ou CH3[2].
Les variantes proviennent surtout de substitution d'acide aminé en position 2 et 4 ou bien du retrait/ajout d'un groupement méthyle sur les fonctionnalités 3 et 7. Les acides aminés les plus communs à la position X sont la leucine (L), l'arginine (R) et la tyrosine (Y), tandis qu'à la position Z on retrouve le plus souvent l'arginine (R), l'alanine (A) et la méthionine (M) [3]. Le tableau suivant présente les différents acides aminés retrouvés à chaque position et la combinaison de ces possibilités explique le fait qu'il y ait tout autant de microcystines.
| AA 1 | AA 2 | AA 3 | AA 4 | AA 5 | AA 6 | AA 7 |
|---|---|---|---|---|---|---|
| D-Ala | L-Leu | D-MeAsp | L-Arg | Adda | D-Glu | Mdha |
| D-Ser | L-Arg | D-Asp | L-Aib | ADMAdda | D-MeGlu | Dha |
| L-Ala | L-Ala | DMAdda | E (OMe) | Dhb | ||
| L-Glu | L-Glu | (6Z) Adda | L-Ala | |||
| L-GluMe | L-GluMe | L-MeSer | ||||
| L-Har | L-Har | L-Ser | ||||
| L-Hil | L- Hph | Mdhb | ||||
| L-Hph | L-Hty | MeLan | ||||
| L-Hty | L-Leu | |||||
| L-Met | L-Met | |||||
| L-Met (O) | L-Met (O) | |||||
| L-Phe | L-Phe | |||||
| L-ThTyr | L-Trp | |||||
| L-Trp | L-Tyr | |||||
| L-Tyr | L-Val |
Aib = Acide Aminoisobutytique ADMAdda = O-acétyl-O-déméthylAdda Dha = Déhydroalanine Dhb = Déhydrobutyrine DMAdda = O-déméthylAdda E (OMe) = acide Glutamique méthylester Har = Homoarginine Hil = Homoisoleucine Hph = Homophénylalanine Hty = Homotyrosine MeLan = N-méthylanthionine Met (O) = Méthionine-S-oxide MeSer = N-Méthylsérine ThTyr = 1, 2, 3, 4-tétrahydrotyrosine (6Z) Adda = Stéréo-isomère de Adda
Selon leur composition, les microcystines présentent une gamme de poids moléculaires localisée entre 900 - 1100 Da. Ces molécules sont particulièrement solubles dans l'eau et peu volatiles. À cause de leurs structures cycliques, elles sont particulièrement résistantes face aux conditions ambiantes et elles tolèrent différentes conditions de pH et de températures. Qui plus est , elles peuvent rester stables pendant des années si elles ne sont pas en contact avec la lumière[5].
Toxicité
Les microcystines sont des hépatotoxines. Ces molécules sont des inhibiteurs de protéines de types phosphatases (PP1 ou PP2A) qui exécutent la déphosphorylation de phosphoprotéines intracellulaires eucaryotes. Leur inhibition entraîne un dérèglement de la structure de la cellule résultant en la nécrose de celle-ci. Une nécrose massive des hépatocytes entraîne une hémorragie interne et ultimement la mort. Qui plus est , la phosphorylation excessive de protéines anti-tumorales, fait en sorte que les microcystines sont reconnues comme des promoteurs de tumeurs[6].
La toxicité des différentes variantes de la microcystine n'est pas la même et elle serait dépendante de la méthylation de certains acides aminés. Quand l'entité Adda est méthylé, la toxicité de la microcystine diminue énormément, suggérant que cette partie de la molécule est le site d'interaction majeur avec les phosphatases[7]. Qui plus est , la forme linéaire des microcystines s'est vu consacrée pour être cent fois moins toxique[8].
Notes et références
- ↑ C. Svrcek, D. W. Smith, Cyanobacteria toxins and the current state of knowledge on water treatment options : a review, J. Environ. Eng. Sci. 3 : 155-184, 2004.
- ↑ World Health Organisation (WHO), Toxic cyanobacteria in Water : A guide to their public health consequences, monitoring and management, 1ère edition, 1999.
- ↑ C. Svrcek, D. W. Smith, Cyanobacteria toxins and the current state of knowledge on water treatment options : a review, J. Environ. Eng. Sci. 3 : 155-184, 2004.
- ↑ S. Hiller, B. Krock, A. Cembella, B. Luckas, Rapid detection of cyanobacterial toxins in precursor ion mode by liquid chromatography tandem mass spectrometry. Journal of mass spectrometry : 42 (9), 1238-1250, Sep 2007.
- ↑ Agence française de sécurité sanitaire de l'environnement et du travail (AFSSET), Évaluation des risques liés à la présence de cyanobactéries et de leurs toxines dans les eaux conçues pour l'alimentation, à l'eau de baignade ainsi qu'aux autres activités récréatives, juillet 2006.
- ↑ World Health Organisation (WHO), Toxic cyanobacteria in Water : A guide to their public health consequences, monitoring and management, 1ère edition, 1999.
- ↑ L. A. Lawton, C. Edwards, Review : Purification of microcystins, Journal of Cromatography A 912 : 191-209, 2001.
- ↑ World Health Organisation (WHO), Toxic cyanobacteria in Water : A guide to their public health consequences, monitoring and management, 1ère edition, 1999.
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 20/03/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité